Usuwanie jonu amonowego z wody podziemnej

Można wyróżnić trzy podstawowe metody usuwania azotu amonowego:
-
odgazowanie,
-
biologiczna nitryfikacja,
-
wymiana jonowa.
Spośród wymienionych sposobów najczęściej stosowana jest metoda druga. Nitryfikacja zachodzi często przy okazji innych procesów uzdatniania wody podziemnej np.: usuwania manganu czy żelaza. Aby proces nitryfikacji przebiegał z wystarczającą efektywnością konieczne jest przestrzeganie ścisłych zasad technologicznych.
W artykule przedstawiono podstawowe zagadnienia teoretyczne procesu nitryfikacji oraz wyniki badań pilotowych nad usuwaniem azotu amonowego prowadzonych w ZUW w Świnoujściu.
1. Metody usuwania azotu amonowego z wody podziemnej
Na formę występowania azotu amonowego w wodzie podziemnej bezpośredni wpływ ma odczyn wody, zgodnie z równaniem równowagi:
NH4+ + OH- = NH3 + H2O
Im odczyn wody jest wyższy, tym więcej azotu amonowego występuje w formie gazowej, jako NH3. Przy wartościach pH typowych dla wód naturalnych azot amonowy wystepuje prawie wyłącznie jako jon NH4+. Występowanie azotu amonowego w formie NH3 (przy wysokim odczynie wód pozwala usunąć ten związek przy użyciu napowietrzania otwartego. Metoda ta pozwala na usunięcie całego azotu amonowego występującego w formie gazowej, przy zachowaniu:
-
maksymalnego rozdeszczenia napowietrzanej wody, pozwalającego zwiększyć powierzchnię międzyfazową wymiany gazów,
-
efektywnego odprowadzenia wydzielonych w czasie napowietrzania gazów.
Urządzeniami nadającymi się do tego celu są m.in. kaskady napowietrzające i złoża ociekowe. Metodą napowietrzania nie da się jednak usunąć z wody amoniaku w postaci NH4+, dominującego w wodach podziemnych o odczynie zbliżonym do obojętnego. Podwyższanie pH podnosi efektywność usuwania azotu amonowego w procesie napowietrzania, jednak jest to metoda kosztowna i wymagająca dawkowania do wody reagentów chemicznych.
W klasycznych układach uzdatniania wody podziemnej usuwanie azotu amonowego w ilościach nie przekraczających 1,0 mgNH4+/L może odbywać się przy zachowaniu pewnych zasad technologicznych przy okazji procesów odżelaziania i odmanganiania wody w procesie filtracji przez złoże filtracyjne. Poniżej zostaną przedstawione warunki efektywnego usuwanie azotu amonowego z wody na drodze nitryfikacji.
Nitryfikacja azotu amonowego - teoria
Biologiczne utlenianie jonu amonowego odbywa się w toku dwuetapowej nitryfikacji.
W pierwszym etapie bakterie Nitrosomonas utleniają jon amonowy do jonu azotynowego NO2-. W drugim natomiast bakterie Nitrobacter utleniają powstałe w pierwszym etapie azotyny do azotanów. Oba gatunki bakterii wykorzystują do przebiegu wspomnianych procesów tlen oraz dwutlenek węgla jako źródło węgla.
Przebieg procesu nitryfikacji można zilustrować w następujących reakcjach
I etap - bakterie Nitrosomonas:
15 CO2 + 13 NH4+ → 10 NO2- + 3C5H7O2N + 23 H+ + 4 H2O + 270 kJ/mol
II etap bakterie Nitrobacter:
5CO2 + NH4+ + 10 NO2- + 2 H2O → 10 NO3- + C5H7O2N + 80 kJ/mol
C5H7O2N - uproszczony wzór chemiczny komórki bakteryjnej
Efektywny przebieg procesu biochemicznego utleniania amoniaku wymaga długich czasów kontaktu. Szybkość wzrostu bakterii nitryfikacyjnych zależy od stężeniem tlenu i amoniaku jako podstawowych substratów procesu, a także w mniejszym stopniu od zawartości ortofosforanów i zasadowości wody.
Podstawowymi czynnikami wpływającymi na efektywność procesów biochemicznego utleniania azotu amonowego z wód podziemnych są:
-
Stężenie tlenu rozpuszczonego. Stechiometrycznie ilość tlenu potrzebna do utlenienia jonu amonowego do jonu azotynowego (I etap nitryfikacji) jest równa 3,43 mgO2/mgN, a dla drugiego etapu (utlenienie jonu azotynowego do azotanowego) wynosi 1,14 mgO2/mgN. W sumie na oba etapy nitryfikacji potrzeba 4,57 mgO2/mgN. Praktyka pokazuje, że rzeczywiste zużycie tlenu na procesy nitryfikacji zazwyczaj jest niższe. Istnieje minimalna wartość stężenia tlenu w wodzie, poniżej której znacznie obniża się prędkość nitryfikacji. Dla pierwszej fazy (bakterie Nitrosomonas) wartość ta wynosi 2,0 mgO2/L, dla drugiej (bakterie Nitrobacter) 4,0 mgO2/L. Proces nitryfikacji ustaje gdy stężenie O2 obniży się poniżej 0,08 mgO2/L (w praktyce poniżej 0,20 mgO2/L).
-
Temperatura. Ze względu na fakt, iż bakterie nitryfikacyjne są organizmami mezofilnymi optymalna temperatura dla ich rozwoju wynosi 28 - 36 oC. Proces przebiega bez większych zakłóceń i wystarczająco efektywnie przy temperaturze 8,0 - 12,0 oC. Literatura podaje, że minimalną temperaturą dla nitryfikacji są 2,0-4,0 oC.
-
Odczyn wody. Odczynem optymalnym dla przebiegu nitryfikacji jest 7,6 (według niektórych źródeł 7,2). Przy odczynie niższym od 6,6 wydajność nitryfikacji spada o ponad połowę. W wyniku biochemicznego utleniania azotu amonowego następuje spadek wartości zasadowości wody, co ma znaczenie zwłaszcza w przypadku wód o bardzo niskiej zasadowości. Obniżenie zasadowości wynosi 7,0 mgCaCO3/1,0 mgNH4+. W wodach o słabych zdolnościach buforujących możemy mieć do czynienia z lokalnymi spadkami pH, które spowalniają przebieg procesu nitryfikacji. Nitryfikacja ustaje, gdy wartość zasadowości spada poniżej 25,0 mgCaCO3/L. Praktyka pokazuje, że przy zasadowości < 50,0 mgCaCO3/L zauważa się wyraźne spowolnienie procesu.
-
Substraty i produkty reakcji. Bakterie Nitrosomonas (pierwsza faza nitryfikacji) są wrażliwe na nadmierne stężenie jonów NO2- (nagromadzenie produktów własnego metabolizmu), natomiast Nitrobacter na nadmierne stężenie jonu amonowego - NH4+. Dotyczy to stężeń znacznie przekraczających wartości występujące w wodach naturalnych.
W przebiegu procesu nitryfikacji wyróżnia się cztery obszary, w których obserwuje się wyraźny wpływ stężenia substratów i pH na efektywność procesu [1]:
-
obszar całkowitej inhibicji procesu wskutek obniżenia pH poniżej 5,0 (zakwaszenia produktami reakcji I etapu (azotynami w postaci kwasu azotowego (II)),
-
obszar całkowitej inhibicji procesu wskutek nadmiernego stężenia amoniaku cząsteczkowego i pH > 7,7,
-
obszar inhibicji utleniania azotynów (NO2-),
-
obszar pełnego przebiegu nitryfikacji dla pH 5,5 - 7,5, przy zawartości azotu amonowego < 50,0 mgNH4/L)
Należy zwrócić uwagę, że metoda biologicznego utleniania jonów amonowych nie powoduje usunięcia z wody związków azotu, a powoduje jedynie zmianę formy ich występowania. Biorąc zatem pod uwagę fakt, iż obowiązujące rozporządzenie ogranicza stężenie w wodzie zarówno związków azotu amonowego jak i azotu azotanowego przy wysokim stężeniu N-NH4+ i przy wysokiej sprawności nitryfikacji może dojść do przekroczenia wartości azotanów w uzdatnionej wodzie.
Badania pilotowe procesu nitryfikacji Biochemiczna metoda utleniania jonów amonowych przy udziale bakterii Nitrobacter i Nitrosomonas zachodzi w złożach filtracyjnych. Efektywność procesu zależy od zastosowanego złoża oraz warunków technicznych i hydraulicznych procesu filtracji. Konieczne jest wpracowanie złoza filtracyjnego do usuwania azotu amonowego w procesie nitryfikacji. Przez wpracowanie złoża rozumie się proces zasiedlania powierzchni i porów wewnętrznych ziaren materiału filtracyjnego przez bakterie nitryfikacyjne, żyjące lub występujące w formie przetrwalnikowej w warstwie wodonośnej i wydobywane na powierzchnię ziemi wraz z wodą surową. Naturalne wpracowanie złóż przebiega w bardzo różnym czasie. Znane są przypadki uzyskania aktywności nitryfikacyjnej złoża, filtrującego wodę podziemną w ciągu kilkunastu dni. Niekiedy jednak proces ten trwa znacznie dłużej, przekraczając nawet pół roku.
Jednym z czynników, który może przyspieszyć wpracowanie złóż do procesu nitryfikacji jest stosowanie złóż o wysokiej porowatości wewnętrznej. Do takich złóż należy węgiel aktywny oraz złoże chalcedonitowe. Chalcedonit stosuje się w klasycznych układach jednoczesnego usuwania z wody podziemnej żelaza, manganu i azotu amonowego. Chalcedonit cechuje porowatość w zakresie porów wewnętrznych (mikro- i mezo- porów) na poziomie około 15 - 30 %. W związku z powyższym złoże to posiada bardzo dobre warunki do zasiedlania i rozwoju bakterii nitryfikacyjnych. Potwierdziły to badania pilotowe procesu nitryfikacji na złożach chalcedonitowych, prowadzone na Stacji Uzdatniania Wody „Odra". Wyniki tych badań zostaną omówione w dalszej części artykułu.
2. Stacja Uzdatniania Wody „Odra"
Stacja Uzdatniania Wody „Odra" jest jednym z trzech obiektów eksploatowanych przez Zakład Wodociągów i Kanalizacji w Świnoujściu. Wodociągi przejęły stację w bardzo złym stanie od nieistniejącego już Przedsiębiorstwa Połowów Dalekomorskich „Odra". Od początku istnienia obiektu istniały problemy z uzyskaniem jakości wody uzdatnionej na poziomie zgodnym z obowiązującymi normami. Stacja czerpie wodę z dwóch czwartorzędowych ujęć podziemnych. Wskaźniki jakości wody surowej zamieszczono w tabeli 1.
Tabela 1. Jakość wody ujmowanej na potrzeby ZUW Odra.
Ujęcie WYDMY
Mętność
NTU
Barwa
mgPt/L
pH
Zasadowość
mgCaCO3/L
**0,0 - 1,7**
7 - 12
7,1 - 8,3
100 - 110
Amoniak
[mg/N-NH4/L]
Żelazo
[mgFe/L]
Mangan
[mgMn/L]
Utlenialność
[mgO2/L]
**0,25 - 1,33**
0,17 - 0,40
0,11 - 0,21
1,8 - 3,3
Ujęcie ODRA
Mętność
NTU
Barwa
mgPt/L
pH
Zasadowość
mgCaCO3/L
**0,0 - 2,6**
43 - 86
7,6 - 8,1
160 - 230
Amoniak
[mg/N-NH4/L]
Żelazo
[mgFe/L]
Mangan
[mgMn/L]
Utlenialność
[mgO2/L]
**1,9 - 5,5**
1,24 - 3,3
0,51 - 0,72
5,6 - 17,0
Ujęcie Wydmy eksploatuje poziom wodonośny o dobrej jakości. Stężenie żelaza i amoniaku w niektórych studniach mieści się w normie. Również utlenialność osiąga poziom, który wyklucza możliwość występowania związków żelaza, czy manganu w postaci kompleksów organicznych. Inna sytuacja ma miejsce w przypadku studni ujęcia „Odra". W wodzie tej przekroczone są wskaźniki: amoniak do 5,5 mgN-NH4+/L, mangan do 0,72 mgMn/L, żelazo do 3,3 mgFe/L, utlenialność do 17,0 mgO2/L i barwa rzeczywista do 86mgPt/L. Żelazo i mangan występują w postaci trudnousuwalnych kompleksów organicznych. Stężenie amoniaku osiąga poziom, przy którym należy zadbać o wysokoefektywne napowietrzanie wody.
Zarówno ujęcie Odra jak i Wydmy mają pozwolenia wodno-prawne na 60,0 m3/h - w sumie 120,0 m3/h i jest to docelowe zapotrzebowanie na wodę ze Stacji Odra.
Problemy technologiczne na SUW „Odra" pojawiły się w momencie włączenia do eksploatacji studni ujęcia Wydmy. W związku z powyższym podjęto decyzję o modernizacji technologii uzdatniania wody. Pierwszym krokiem były badania pilotowe.
Badania pilotowe na SUW Odra
Badania prowadzone były przez ponad 6 miesięcy. Wykorzystano do tego celu klasyczną instalację badawczą, składającą się z trzech kolumn o średnicy wewnętrznej 9,0 cm i wysokości 3 m, wykonanych z pleksi. Kolumny zasypano złożem chalcedonitowym o uziarnieniu: 0,8 - 2,0 mm i wysokości warstwy filtracyjnej równej 2,0 m. Złoże spoczywało na 0,4 m warstwie podtrzymującej (o uziarnieniu 2,0-8,0 mm). Układ pracował w systemie filtracji jednostopniowej i dwustopniowej. Filtrację jednostopniową prowadzono na kolumnie oznaczanej dalej jako FIII, natomiast filtrację dwustopniową na kolumnach FI (pierwszy stopnień) i FII (drugi stopień). Pomiędzy pierwszym, a drugim stopniem wodę wtórnie napowietrzano i przetłaczano pompką.
Kolumny filtracyjne wyposażone były w:
-
kurki probiercze (10 sztuk) rozmieszczone równomiernie na wysokości złoża,
-
piezometry (10 sztuk) na tych samych wysokościach co kurki probiercze,
-
stabilizator przepływu z rotametrem,
-
instalację płuczącą wodą oraz powietrzem.
Plan badań zakładał:
-
filtrację z prędkością 6,0 m/h na wszystkich kolumnach,
-
płukanie po osiągnięciu strat hydraulicznych w złożu równych 2,5 - 3,0 mH2O,
-
wykonywanie analiz po każdym stopniu filtracji w zakresie:
-
wszystkich form azotu mineralnego,
-
tlenu, odczynu wody,
-
żelaza, manganu, barwy, mętności,
-
temperatury, zasadowości, utlenialności,
-
-
odczyty ciśnienia z piezometrów na różnych głębokościach złoża i na tej podstawie wyznaczenie strat ciśnienia wody,
-
płukanie w trybie: woda (5,0 min) - powietrze (2,0 - 3,0 min) - woda (do czystych popłuczyn); płukanie wodą odbywało się z intensywnością, gwarantującą 25 % ekspansję złoża.
W toku badań prześledzono proces wpracowania złoża do usuwania manganu oraz azotu amonowego, a także efektywność usuwania barwy i utlenialności w toku procesu koagulacji powierzchniowej.
Wyniki badań - nitryfikacja
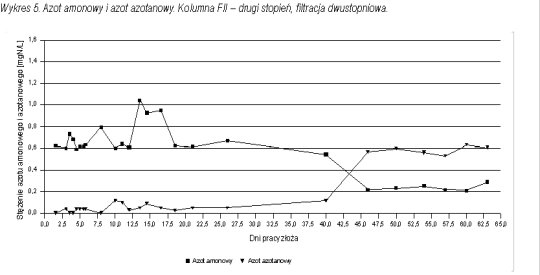
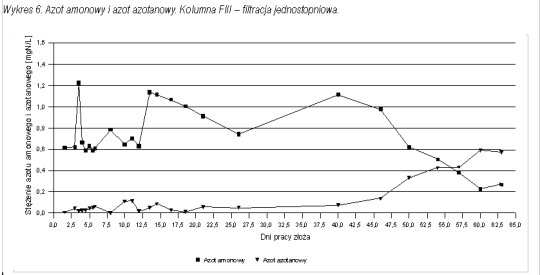
Pomiary stężenia azotu amonowego pozwoliły prześledzić proces wpracowania złoża chalcedonitowego do procesu nitryfikacji. Na wykresach 1 - 3 przedstawiono przebieg wpracowania do procesu nitryfikacji na poszczególnych kolumnach filtracyjnych.
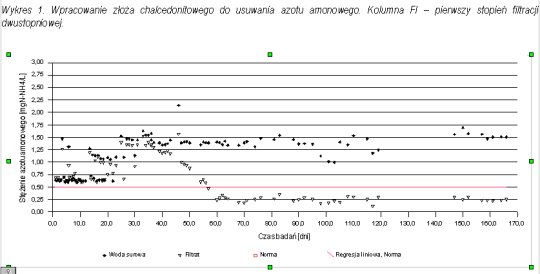
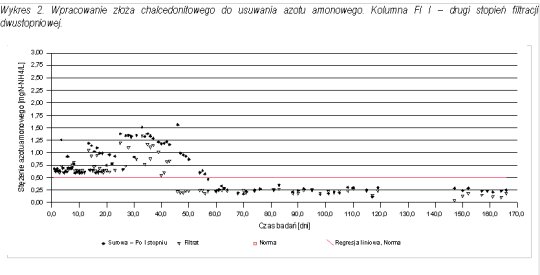
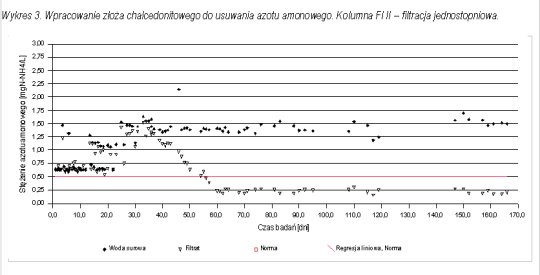
W przypadku filtracji dwustopniowej pierwszy wpracował się drugi stopień. Po 45 dniach filtracji osiągnięto zawartość azotu amonowego w filtracie na poziomie zgodnym z normą. Był to moment, w którym zaczynało się wpracowanie kolumny FI (pierwszego stopnia). Zarówno na FI jak i FIII (filtracja jednostopniowa) uzyskano porównywalny czas wpracowania do usuwania azotu amonowego równy około 60 dni.
Po wpracowaniu pierwszego stopnia w filtracji dwustopniowej, na stopień drugi (kolumna FII) trafiała woda pozbawiona azotu amonowego (ilości śladowe). W każdym przypadku (filtracja jedno i dwustopniowa) po osiągnięciu wpracowania do usuwania azotu amonowego proces nitryfikacji przebiegał stabilnie, a stężenie azotu amonowego mieściło się poniżej normy.
Wraz ze spadkiem zawartości azotu amonowego w wodzie uzdatnionej rosła zawartość azotanów. Stężenie tego związku obserwowano do momentu wpracowania złóż do usuwania jonu amonowego. Na wykresach 4 - 6 przedstawiono postęp procesu nitryfikacji w formie zależności stężeń azotu amonowego i azotanowego od czasu pracy złoża. We wszystkich trzech kolumnach można zauważyć, że w momencie, gdy zaczyna spadać stężenie azotu amonowego w wodzie uzdatnionej wzrastają azotany.
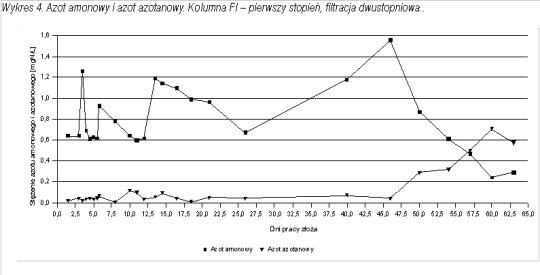
Poszczególne formy azotu nie bilansowały się. Suma różnych form mineralnych azotu (amonowy, azotanowy i azotynowy) na wejściu na kolumnę nie była równa sumie tych form na wyjściu z kolumny. Azot mineralny w filtracie był niższy od azotu mineralnego w dopływie na filtry.
Na wykresie 7 przedstawiono różnicę w stężeniu azotu mineralnego w wodzie surowej i w filtracie.
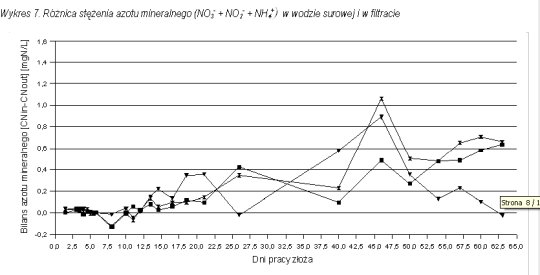
W przypadku złoża FI i FIII (odpowiednio pierwszy stopień filtracji dwustopniowej i filtracja jednostopniowa) różnica w ilości azotu mineralnego w wodzie surowej i uzdatnionej rośnie w miarę wpracowania złoża do usuwania amoniaku. Po 65 dniach pracy w wodzie surowej jest o około 0,6 mgN/L azotu mineralnego więcej niż w wodzie uzdatnionej. W przypadku kolumny FII (drugi stopień filtracji dwustopniowej) do momentu kiedy na kolumnę docierała podwyższona ilość azotu amonowego rosła również różnica pomiędzy stężeniem azotu mineralnego na wejściu i wyjściu z kolumny. Od czasu, gdy ilość azotu amonowego na wejściu na FII zaczęła spadać (wpracowanie kolumny FI) również stopniowo malała różnica pomiędzy sumą poszczególnych form azotu na wejściu i wyjściu z kolumny, by z wartości maksymalnej ( 45 dzień) spaść do wartości bliskiej zero, przy której azot mineralny bilansuje się.
Z procesem nitryfikacji wiążą się dodatkowo następujące zmiany w chemizmie uzdatnianej wody:
-
spadek zawartości tlenu zużywanego na procesy biologiczne,
-
spadek zasadowości wody,
-
obniżenie odczynu.
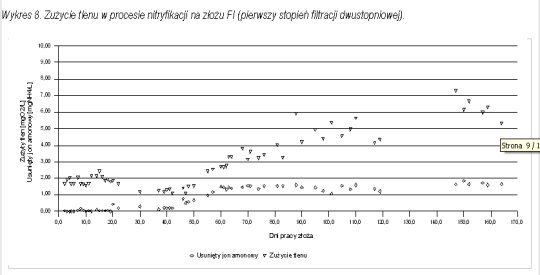
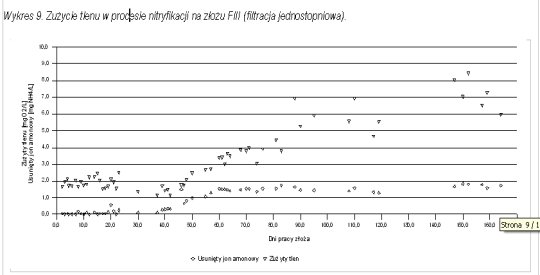
Wszystkie z wymienionych zjawisk zaobserwowano w toku badań pilotowych. Na wykresach 8 i 9 przedstawiono zużycie tlenu (liczone jako różnica pomiędzy stężeniem tlenu na dopływie i w odpływie z filtra) na procesy biologiczne i chemiczne na kolumnach FI i FIII w zależności od czasu pracy złoża. Na wykresach tych przedstawiono również przebieg zmian wartości różnicy stężenia azotu amonowego w dopływie i w odpływie z filtra w zależności od czasu pracy złoża. Jak widać w obu przypadkach w początkowym okresie badań zużycie tlenu, osiąga wartość 1,5 - 2,0 mgO2/L. Biorąc pod uwagę fakt, że stężenie amoniaku w tym czasie praktycznie nie ulega zmianie, zużycie tlenu może wiązać się z utlenieniem żelaza i innych łatwo utlenialnych substancji. Wyznaczone średnie zużycie tlenu na 1 mg usuniętego jonu amonowego wynosi:
-
dla kolumny FI - w fazie ustabilizowanej nitryfikacji - 3,04 mgO2/L,
-
dla kolumny FIII - w fazie ustabilizowanej nitryfikacji - 3,24 mgO2/L.
Jest ono zatem niższe o blisko 25 % od zużycia stechiometrycznego. Jeżeli odjąć od zużycia tlenu po procesie wpracowania wartość stałą z pierwszego etapu badań i na tej podstawie wyznaczyć zapotrzebowanie na tlen w procesie nitryfikacji wówczas wyniosłoby ono:
-
dla kolumny FI: 2,32 mgO2/L na każdy miligram usuniętego jonu amonowego,
-
dla kolumny FIII: 2,12 mgO2/L na każdy miligram usuniętego jonu amonowego.
Dla takich założeń zapotrzebowanie na tlen jest blisko dwukrotnie niższe od stechiometrycznego.
W toku prowadzonych badań zauważono również wpływ nitryfikacji na obniżenie odczynu uzdatnianej wody. Wykresy 10 - 12 przedstawiają zmianę odczynu wody w zależności od czasu pracy złoża. Na wykresach tych przedstawiono również zmianę stężenia azotu amonowego w filtracie w czasie pracy złoża.
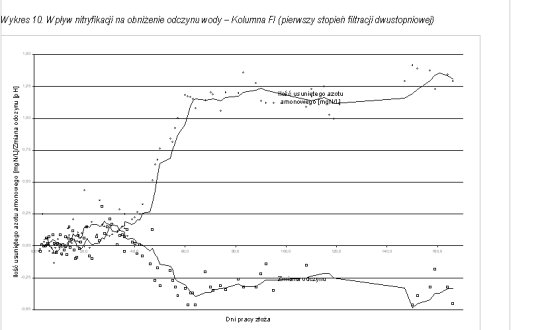
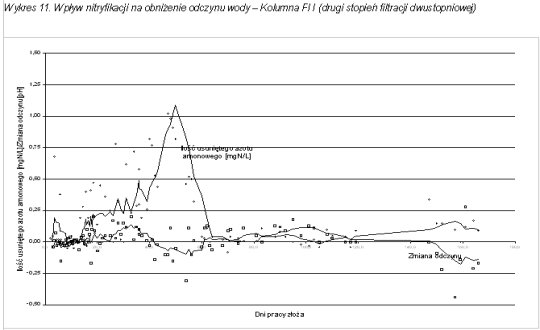
Średni spadek odczynu przy nitryfikacji 1,00 mg azotu amonowego wynosił 0,22 [pH]. W początkowej fazie badań nie zaobserwowano większych zmian odczynu, co pozwala wyeliminować wpływ innych procesów (jak usuwanie żelaza) na obniżanie pH. Dopiero od początku wpracowywania się złoża do nitryfikacji i spadku stężenia azotu amonowego w filtracie obserwuje się wyraźny spadek odczynu wody.
W czasie prowadzonych badań zaobserwowano również spadek wartości zasadowości wody wraz ze spadkiem stężenia azotu amonowego w filtracie, które nastąpiło po procesie wpracowania złoża. W miarę rozwoju błony biologicznej obserwowano średnie zmniejszenie zasadowości wody przefiltrowanej na poziomie 5,0 – 10,0 mgCaCO3/L.
Podsumowanie i wnioski
Badania nad nitryfikacją azotu amonowego na złożach chalcedonitowych pozwalają na wyciągnięcie następujących wniosków:
-
szybkiemu wpracowaniu złoża chalcedonitowego do usuwania azotu amonowego z wody podziemnej w procesie nitryfikacji sprzyja wysoka porowatość wewnętrzna ziaren złoża, sięgająca 30 %,
-
w badaniach na SUW Odra, przy prędkości filtracji 6,0 m/h czas wpracowania wyniósł odpowiednio: dla pierwszego stopnia filtracji dwustopniowej: 58 dni, dla drugiego stopnia filtracji dwustopniowej: 42 dni, dla filtracji jednostopniowej: 56 dni,
-
różnica 15 dni w czasie wpracowania do usuwania jonu amonowego kolumny FI (pierwszego stopnia) i FIII (filtracja jednostopniowa) wskazuje na możliwe występowanie czynników zakłócających nitryfikację w wodzie surowej; czynniki te mogła usunąć filtracja pierwszego stopnia i dlatego drugi stopień wpracował się w krótszym czasie,
-
szybszemu wpracowaniu II stopnia filtracji mógł sprzyjać:
-
-
dłuższy, 7-dobowy cykl filtracyjny na drugim stopniu filtracji, wynikający z niskiego przyrostu strat ciśnienia (woda na drugi stopień filtracji była pozbawiona żelaza), w stosunku do 2-5 dobowych cykli na pierwszym stopniu; kolumna FII była rzadziej płukana, co ograniczało zrywanie wykształconej błony biologicznej,
-
brak żelaza w wodzie trafiającej na drugi stopień filtracji – złoże na drugim stopniu było czyste, pory wewnętrzne ziaren otwarte, co również mogło poprawić warunki rozwoju błony biologicznej,
-
-
-
efektywność procesu nitryfikacji, po wpracowaniu była wysoka i stała w czasie,
-
jon amonowy był w całości utleniany do azotanów, stężenie azotynów znajdowało się na bardzo niskim poziomie, bliskim granicy oznaczalności,
-
zmniejszaniu stężenia azotu amonowego z wody surowej towarzyszyło obniżenie:
-
-
tlenu (po korekcie w ilości 2,2 mgO2/L na 1 mgNH4+/L)
-
odczynu wody (średnio 0,22 pH na 1 mgNH4+/L),
-
zasadowości (średnio 10,0 mgCaCO3/L)
-
-
-
bilans azotu mineralnego (azotany, azotyny i jon amonowy), wskazuje, że stężeniae azotu mineralnego w wodzie trafiającej na kolumny jest większa niż w wodzie przefiltrowanej, co ma związek z udziałem asymilacji azotu amonowego; proces ten był opisywany w literaturze [4],
-
potwierdzeniem asymilacji azotu amonowego w procesie usuwania tego związku z wody jest niższe od stechiometrycznego zużycie tlenu i niższa niż stechiometryczna produkcja azotanów i azotynów,
Jak wykazały opisane badania złoże chalcedonitowe jest wysokoefektywnym materiałem filtracyjnym, który może być wykorzystywany w układach z jednoczesnym usuwaniem żelaza, manganu oraz jonu amonowego.
Bibliografia
-
Wąsowski J.: „Wybrane wysokoefektywne procesy w technologii uzdatniania wody” Materiały konferencji „Zaopatrzenie w wodę miast i wsi”; Poznań 1992
-
Nawrocki J.; Biłozor S.: „Uzdatnianie wody”; Wydawnictwo Naukowe PWN; Warszawa – Poznań 2000.
-
Kowal A.; Świderska – Bróż M.: „Oczyszczanie wody”; PWN Warszawa – Wrocław 2000.
-
Błażejewski M.; Pruss A.: „Niektóre problemy odmanganiania w przypadku zawartości w wodzie azotu amonowego”; Materiały konferencji „Zaopatrzenie w wodę. Jakość i ochrona wód”; Kraków – Poznań 2000.
PODZIĘKOWANIA
Autorzy artykułu pragną serdecznie podziękować pracownikom Zakładu Wodociągów i Kanalizacji w Świnoujściu, czynnie uczestniczących w badaniach technologicznych na SUW Odra. W szczególności pani dyr. Małgorzacie Bogdał, pracownikom laboratorium ZWiK pod kierownictwem pani Anny Majewskiej, pracownikom Działu Produkcji Wody z panami Piotrem Deresińskim, Andrzejem Marynowskim i Piotrem Sabalskim.
Dzięki bardzo pozytywnej atmosferze współpracy oraz skrupulatności prowadzonych analiz i obserwacji, badania udało się przeprowadzić sprawnie i owocnie, gromadząc przy tym obszerny i cenny materiał naukowy.
Autorzy:
dr inż. Joanna Jeż - Walkowiak
mgr inż. Łukasz Weber